
崇城大学 薬学部 生化学研究室
大栗誉敏
☆研究背景
*抗体医薬品について
*抗体医薬品の問題点
*抗体フラグメントFab
*Fabの医薬品への応用
☆研究課題
1)抗体医薬品のFab化及び酵母による産生
2)抗体医薬Fabのアミノ酸変異導入による改変
3)Fabの体内動態の改善
4)Fabの抗原性に関する研究
研究背景
現在、抗体医薬品が盛んに開発されており、2018年の医薬品売り上げランキングでは抗体医薬品のヒュミラが1位であり、他の抗体医薬品も10位以内に3品目入っている。
主に、がんやリウマチなどの難治性疾患に高い効果を発揮している。
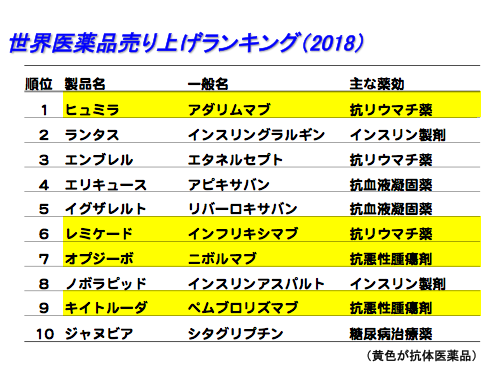
がんを例に挙げる。体の中の細胞の多くは、細胞分裂を繰り返して新しい細胞を生み出し、古くなると死んでいく。重要なのは不要な細胞が死ぬということである。
がん細胞は、正常な細胞のDNAが損傷するなどによって不死の細胞へと変化し、無限に増殖するようになった細胞である。
従来の抗がん剤による治療では、がん細胞だけでなく正常な細胞も破壊してしまうので激しい副作用を引き起こすという問題がある中で、近年の研究により、がん細胞は正常細胞ではあまり見られない分子を、細胞の表面に現れていることが分かってきた。
このがん細胞に多く現れている分子を狙えば、正常細胞を壊さずにがん細胞のみを攻撃することが可能となり、それを担っているのが抗体である。
抗体は優れた特異性を持ち、標的分子に対してのみ作用することから副作用の低減が期待できる。
がんをはじめとした病気の原因となる分子に対し、特異的に作用するのが抗体医薬品である。
さらに抗体は体内にある免疫システムの一員であるために、抗体がとらえた相手には免疫システムの他の仲間も加わって攻撃がなされる。

抗体医薬品はタンパク質である。
遺伝子工学の発展により設計図となる遺伝子さえあれば、微生物や動物細胞を使ってタンパク質を作り出すことが可能である。
抗体はタンパク質として合成されたあとH鎖のFc領域(下記の構造を参照)に糖鎖が付加するというイベントが必須である。
この糖鎖付加が必要なこと、そして抗体の分子が大きくて少し複雑な構造をしていることから、簡便な微生物で抗体を生産するのは難しく、
高等動物である哺乳類の細胞(主流はチャイニーズハムスターの細胞:CHO細胞)を用いて生産されている。
微生物に比べると、動物細胞の扱いは大変であり、抗体医薬品として抗体を生産する為には莫大な設備投資が必要である。
即ち、抗体医薬品の問題点の1つは、生産コストがかかるという点である。
抗体医薬品は血中に最も多く存在するIgGが使われている。
IgGは、H鎖が2本とL鎖が2本の4本のポリペプチドが組み合ってできている。
先の領域(青色)が可変領域であり、ここのアミノ酸配列が変わることによって多様な特異性を生み出している。
他の領域(赤色)は共通したアミノ酸配列の定常領域である。
L鎖と結合せずH鎖同士結合している部分(Y字の棒の部分)をFc領域と呼び、ここの特定の領域に糖鎖が付加する。
またFc領域は他の免疫システムを呼び寄せるのに欠かせず、補体あるいはマクロファージやNK細胞は
抗体のFc領域を認識し、抗体が捕らえた相手を殺傷する(CDC作用・ADCC作用と呼ぶ)。
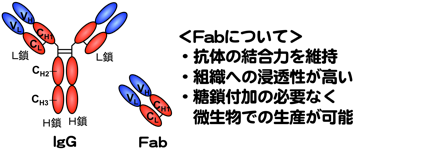
一方で、Fc領域を除いたH鎖とL鎖が結合している部分のフラグメントをFabと呼ぶ。
Fabを単独で調製することが可能で、Fabのみで抗原(抗体が結合する分子)と結合力を維持できる。
さらに抗体分子よりも小さいので、組織に入り込める能力が高くなる。
最大の利点は、Fc領域を欠いているため糖鎖付加の必要性がなく、大腸菌や酵母といった微生物での生産が可能である。
即ち、抗体医薬品の生産コストに対して、Fabであれば生産コストは削減できる。
抗体と比べた時に、生産コストが下げられるという可能性と組織浸透性が高いという能力はFabの強みである。
しかしながらFabにも欠点がある。抗体分子に比べ体内の半減期が大幅に劣る。
これに対し、Fabにポリエチレングリコール(PEG)を付加させて体内半減期が長くなるということが分かっており、かなり抗体分子に近づいているという研究報告がある。
またFc領域が無いので上述した他の免疫システムとの攻撃ができず、中和作用のみの適応に限られる。
中和作用のみで効果があるという症例には炎症性疾患のリウマチなどがあり、炎症性分子のTNFαを狙ったFab製剤が認可され、
医薬品として用いられている(一般名:セントリズマブ
ペゴル。商品総称名:シムジア)。
これは世界初のPEG化Fab抗TNFα製剤であり、PEGを付加させることでFabの欠点である半減期を大幅に長くしてい�驕B
もう1つの欠点であるFc領域が無い為にCDC作用やADCC作用が期待できない事に対して、Fab分子に抗がん剤を融合させれば
がん細胞などを特異的にかつ強力に退治できる(ADA:抗体薬物複合体)。
さらに、新しいがん治療として免疫チェックポイント阻害作用が知られている。中和作用で効果を発揮できるのでFabでの応用も期待できる。
以上のように、Fabは次世代抗体医薬品として期待が高く、研究開発が進んでいる。
☆研究課題
1)抗体医薬品のFab化及び酵母による産生
「抗体医薬品のFab部分を、遺伝子工学的に酵母から作りだす」
Fabは生産コストが安価で培養が容易な大腸菌や酵母などでの生産が可能である。
しかしFabといえど、H鎖L鎖の別々からなる2量体であるため大腸菌や酵母の生産系を確立するのは容易ではない。
以前の研究で、ヒトのFabを大腸菌から封入体として発現させ大量にかつ効率的に作製させる事にした。
[Stable supply of large amounts of human Fab from the
inclusion bodies in E. coli.
Fujii T, Ohkuri T, Onodera R, Ueda T. J Biochem. 2007.
141(5):699-707. ]
また、酵母によっても大量にヒトのFabを大量に調製することに成功した。
[Characterization of deamidation at Asn138 in L-chain of
recombinant humanized Fab expressed from Pichia
pastoris.
Ohkuri T, Murase E, Sun SL, Sugitani J, Ueda T. J Biochem. 2013.
154(4):333-340. ]
さらに抗体医薬品アダリムマブ(ヒュミラ)のFabを酵母より大量に調整することにも成功した。
[A novel engineered interchain
disulfide bond in the constant region enhances the thermostability
of adalimumab Fab.
Nakamura H, Oda-Ueda N, Ueda T, Ohkuri T. Biochem Biophys Res Commun. 2018.
495(1):7-11.]
現在、承認されている抗体医薬品について、Fabの発現系を構築させ酵母を用いて大量に調製する研究をおこなっている。
2)抗体医薬Fabのアミノ酸変異導入による改変
「熱に強いFabや凝集性を抑えたFabを作る」
抗体はタンパク質であるため熱に弱い。タンパク質製剤は精製や保存段階で不可逆的な化学修飾反応や凝集などが起こる可能性があり、品質の不均一化、活性の低下を招くおそれがある。
そのため抗体医薬品は冷所で1~2年の保存期間となり、これもコストが高くなる要因の1つとなっている。
タンパク質は水溶液中で天然状態と変性状態の平衡関係にあり、不可逆的な劣化反応は、変性状態から引き起こされる。
従って、タンパク質の天然構造を安定化すれば劣化反応の進行を抑制することができ、長期保存が可能になると考えられる。
そこでFabの定常領域をターゲットとしてアミノ酸変異による熱安定化を目指している
これまでに抗体医薬アダリムマブFabの定常領域に新規SS結合の導入による熱安定化に成功している。
[A novel engineered interchain
disulfide bond in the constant region enhances the thermostability
of adalimumab Fab.
Nakamura H, Oda-Ueda N, Ueda T, Ohkuri T. Biochem Biophys Res Commun. 2018.
495(1):7-11.]
さらに抗体医薬品の問題の1つである凝集性を抑えるために、アミノ酸変異による糖鎖付加Fabの作製を行い、凝集性を抑えることに成功している。
[Introduction of a glycosylation site in the constant region
decreases the aggregation of adalimumab Fab.
Nakamura H, Oda-Ueda N, Ueda T, Ohkuri T. Biochem Biophys Res Commun. 2018.
503(2):752-756.]
現在、さまざまな変異体を作製し、Fabの熱安定化と凝集抑制に取り組んでいる。
3)Fabの体内動態の改善
「Fabの血中滞留時間を延ばす」
Fabにポリエチレングリコール(PEG)を付加させて血中での滞留時間を伸ばすことは可能であるが、部位特異的にPEGを修飾させることが問題である。
我々はFabのC末端にフリーのSHをもたせ、熱安定性を損なわずに部位特異的にPEG化したFabの作製に成功している。
[C-Terminal Cysteine PEGylation of
Adalimumab Fab with an Engineered Interchain
SS Bond.
Nakamura H, Anraku M, Oda-Ueda N, Ueda T, Ohkuri T.
Biol Pharm Bull. 2020. 43(3):418-423.]
現在、他の分子と融合させ体内動態が改善するFabの作製に取り組んでいる。
4)Fabの抗原性に関する研究
「アミノ酸変異による抗原性の出現を回避する」
タンパク質製剤の問題点は抗原性である。
ヒトにマウス由来の抗体を投与すると、異物とみなされ免疫応答が起こる。
免疫応答が起こらないように、ヒトの配列の抗体医薬品が用いられている。
しかしアミノ酸変異により改変したFabは、抗原性が現れるおそれがある。
我々はモデルタンパク質を用いて、アミノ酸変異が安定性を上昇させる方向であれば抗原性が抑えられるという事を見い出した。
[A
protein's conformational stability is an immunologically dominant factor:
evidence that free-energy barriers for protein unfolding limit the
immunogenicity of foreign proteins.
Ohkuri T, Nagatomo S, Oda K, So T, Imoto T, Ueda T. J Immunol. 2010. 185(7):4199-205. ]
[Relationship
between the magnitude of IgE production in mice and
conformational stability of the house dust mite allergen, Der p 2.
Nakamura
H, Ohkuri T, So T, Ueda T. Biochim
Biophys Acta. 2016
Oct;1860(10):2279-84.]
現在、Fabに対しても抗原性と抗体産生に相関があるかどうか調べている。
崇城大学薬学部 生化学研究室
大栗誉敏 → HP
〒860-0082 熊本市西区池田4-22-1
ohkuri@@ph.sojo-u.ac.jp
研究内容に関する問い合わせなど、気軽にメールで御連絡ください。(@を1つ外してください。)
また大学院生も募集していますので興味ある方も、メールをください。